In dem ersten Jahr unserer Ausbildung lernen wir im Labor viele Basics, wie zum Beispiel die nasschemischen Ionennachweise: Mit welcher Salzlösung kann ich ein anderes Salz nachweisen? Der ein oder andere wird sicherlich mit dem Begriff Ionennachweis etwas anfangen können. Für die, die jetzt noch nicht wissen was damit gemeint ist, zu Ionenverbindungen gehört zum Beispiel Kochsalz. Chemisch wird es als Natriumchlorid bezeichnet.
Wie entstehen Ionen?
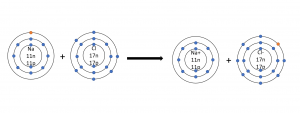
Atome möchten die sogenannte Edelgaskonfiguration erreichen, dafür geben sie entweder ihre Elektronen ab oder nehmen von einem anderen die Elektronen auf. Vielleicht erinnert ihr euch ja an das Atommodell nach Bohr. Hier habt ihr einen Kern mit Neutronen und Protonen gezeichnet und dann je nach Element einige Kreise, die sogenannten Schalen drum herum gezeichnet. In diesem Modell besitzt jede Schale bis auf die äußerste (außer bei Edelgasen) eine mit acht Elektronen voll besetzte Schale. Natrium zum Beispiel hat jetzt nur ein Elektron auf der äußersten Schale. Um nun ebenfalls wie ein Edelgas eine vollbesetzte Schale zu erhalten, gibt es sein Elektron ab und ist damit positiv geladen. Chlor hingegen fehlt ein Elektron auf seiner äußersten Schale, es nimmt also das Elektron von Natrium auf und ist nun negativ geladen. Beide jetzt als Ionen bezeichnete Teilchen haben so den Edelgaszustand erreicht. Aus diesen Ionen bilden sich jetzt Gitter, die unser im Alltag bekanntes Salz ergeben. Auf diese Weise bilden sich sehr viele verschiedene Ionenbindungen und damit viele verschiedene Salze.
Was ist jetzt ein nasschemischer Nachweis?
Nasschemisch bedeutet erstmal, dass die Reaktion der eingesetzten Chemikalien in wässriger Lösung abläuft. Ionen lassen sich sowohl über die Flammenfärbung untersuchen, als auch durch die Bildung von Komplexen oder Fällungsreaktionen. Diese laufen dementsprechend besser in wässriger Lösung ab, da die eigentlich festen Salzbindungen sich voneinander lösen und damit besser mit anderen Teilchen reagieren können. Das Prinzip hinter einer Fällungsreaktion ist, dass sich durch Zugabe einer Nachweisreagenz zu einer Probelösung ein in Wasser schwer löslicheres Salz bildet. Es fällt als Niederschlag aus. Niederschläge bilden sich zum Beispiel auch, wenn ihr zu viel Kochsalz oder Zucker in ein Glas Wasser

gebt. Hier ist es zwar keine Fällungsreaktion, da nur irgendwann die Lösung gesättigt ist, das heißt, es können keine weiteren Teilchen vom Wasser aufgenommen werden. Nach diesem Punkt erhaltet ihr einen Niederschlag aus Salz oder Zucker, die weiter hinzugegebenen Teilchen können sich nicht mehr lösen.
Eben diese Niederschläge bilden sich, wenn zu einer Kochsalzlösung eine Silbernitrat-Lösung hinzugegeben wird. Die Silberionen binden an die vorhandenen Chloridionen. Es bildet sich Silberchlorid. In dieser Verbindung kann sich das Salz nur schwer in Wasser lösen, wodurch es aus der Lösung ausfällt.

Andere Ionen werden nicht durch eine Fällungsreaktion nachgewiesen, sondern durch einen Farbumschlag. Hierbei bildet sich bei der Zugabe einer bestimmten Chemikalie ein Komplex, der eine Farbänderung verursacht. Ein gutes Beispiel dafür ist der Kupfernachweis. Das Salz Kupfersulfat bildet mit Wasser von vornherein bereits eine hellblaue Lösung. Gibt man anschließend Ammoniak hinzu, färbt sich diese Lösung dunkelblau. Es ändert sich hier also die Farbintensität. Ammoniak und Kupfer gehen eine komplexe Bindung ein, woher auch die Farbwahrnehmung kommt.
[…] mit euch geteilt. Sie erklärt einfach, wieso Metalle (wie Natrium) und Nichtmetalle (wie Chlor) Ionenbindungen […]